【成份】
本品主要成份为盐酸伊托必利。
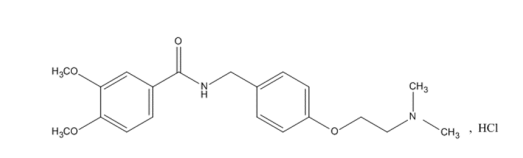
化学名称:N- [4- [2-(N,N二甲基氨基)乙氧基]苄基]-3, 4-二甲氧基苯甲酰胺盐酸盐
化学结构式:
|
≥0.1%~<5% |
<0.1% |
发生率不明① |
|
|
过敏② |
|
|
皮疹、潮红和瘙痒 |
|
|
震颤等 |
|
|
|
内分泌② |
|
血催乳素升高 |
男子乳腺发育 |
|
血液学② |
|
血小板减少,白细胞减少等 |
|
|
胃肠道 |
腹泻、便秘、腹痛等 |
|
|
|
精神神经 |
|
头痛、激动、睡眠改变和头晕 |
|
|
肝脏 |
AST和ALT增高 |
g-GTP增高,碱性磷酸酶(ALP)增高等 |
|
|
肾脏 |
|
尿素氮和肌酐水平增高等 |
|
|
心血管 |
|
|
低血压 |
|
其它 |
|
胸背痛和疲乏感 |
血胆红素升高 |
注:
①来自自发性报告。
② 如发现异常,应立即采取停药等处理措施。
【禁忌】
1.因胃肠动力增强可能加重胃肠道出血、机械性梗阻或穿孔的损害,故此类患者禁用本品。
2.已知对伊托必利过敏,或对本品中的任何成份有过敏史的患者禁用本品。
【注意事项】
1、本品能增强乙酰胆碱的作用,必须谨慎使用。
2、本品使用中若出现心电图QTC间期延长,应停药。
3、虽然未证实本品对驾驶和操作机器的能力有影响,但由于偶尔可发生头晕和激动,故应注意药物对人体机敏性的影响。
4、尚未获得长期用药数据。
【孕妇及哺乳期妇女用药】
生育力:尚无伊托必利对生育力的影响的人体数据。
妊娠:尚无妊娠女性使用伊托必利的数据或数据量有限。作为预防措施,妊娠期间最好避免使用伊托必利。
哺乳:伊托必利可经动物的乳汁分泌,但伊托必利经人乳分泌的信息不足,不能排除对乳儿的风险。在决定停止哺乳还是停止伊托必利治疗之前,应考虑哺乳对婴儿的益处与治疗对母亲的益处。
【儿童用药】
儿童应用本品的安全性尚未确定。
【老年用药】
由于老年人常有生理功能减退,有可能易出现不良反应。老年人在使用本品过程中,应注意仔细观察,若出现不良反应,可减量或停药。
【药物相互作用】
伊托必利的代谢不依赖于细胞色素P450酶,而主要经黄素单氧化酶途径代谢,故不易发生药物代谢方面的相互作用。
本品在血清蛋白结合力方面,未发现与华法林、地西泮(安定)、双氯芬酸、噻氯匹定、硝苯地平和尼卡地平的相互作用。
抗溃疡药物,如西咪替丁、雷尼替丁、替普瑞酮和西曲酸酯不影响本品的促动力作用。
抗胆碱能药物可减弱本品的作用,故应避免合用替喹溴胺、丁溴东莨菪碱、噻哌溴胺等抗胆碱药物。
伊托必利具有促胃动力作用,因此可能影响合并口服药物的吸收。与治疗指数窄的药物、缓释或肠溶药物合用时,应特别谨慎。
【药物过量】
如果药物过量超过一定程度,应采取洗胃和对症治疗等常规措施。
【药理毒理】
药理作用
伊托必利具有多巴胺D2受体拮抗活性和乙酰胆碱酯酶抑制活性,通过两者的协同作用发挥胃肠促动力作用。此外,由于有拮抗多巴胺D2受体活性的作用,尚有一定的抗呕吐作用。
毒理研究
遗传毒性
伊托必利Ames试验、体外人淋巴细胞染色体畸变试验、小鼠体内染色体畸变试验、小鼠微核试验结果均为阴性。一项中国仓鼠肺细胞(CHL)染色体畸变试验结果在最高浓度时为阳性,在另两项试验中使用经培养的CHL结果均为阴性。
生殖毒性
在大鼠生育力试验中,伊托必利≥30mg/kg/天时雌性动物动情周期延长,认为这与继发于高催乳素血症有关。剂量达300mg/kg/天时还可见交配前时间延长。300mg/kg/天剂量下伊托必利在妊娠大鼠中血浆浓度约为人临床给药剂量(50mg)下血清浓度的100倍,该剂量下对大鼠交配或生育力未见不良影响。在大鼠和兔胚胎-胎仔发育毒性试验中,母体剂量高达300mg/kg时未见致畸作用。给药期间,伊托必利剂量达300mg/kg/天时,妊娠兔可见瞳孔缩小、上睑下垂、流泪,及摄食量减少。在围产期毒性试验中,大鼠经口给予伊托必利10、100和300mg/kg/天,对胚胎和子代发育及母体生殖功能均未见影响。伊托必利可经动物的乳汁分泌。
致癌性
尚未开展盐酸伊托必利致癌性试验。
其他
盐酸伊托必利重复经口给药毒性试验中,高剂量30mg/kg/天下大鼠出现可逆性乳腺增生,这可能与高催乳素血症有关;犬(最高剂量100mg/kg/天)或灵长类动物(最高剂量300mg/kg/天)未见此类现象。在犬3个月经口给药毒性试验中,伊托必利30mg/kg/天时可见前列腺萎缩,而在犬6个月更高剂量(100mg/kg/天)、大鼠或猴6个月更高剂量(300mg/kg/天)给药后未观察到该现象。
【药代动力学】
本品口服后在胃肠道吸收迅速、完全,经肝脏首过代谢,其相对生物利用度约为60%。食物对本品生物利用度没有影响。口服本品50mg后,血浆浓度约0.5小时达到峰值(Cmax 0.73μg/ml)。人血清蛋白结合率为96%。
本品在肝脏主要通过黄素单氧化酶途径转化形成代谢物M1、M2和M3。3种代谢物中,仅其中之一有较弱的多巴胺D2受体阻滞作用,无药理学相关性。
本品及其代谢产物主要经肾脏排泄(75%),清除半衰期大约为6小时。本品的促动力作用在治疗剂量范围内与剂量呈线性相关。
【贮藏】 密封,在干燥处保存。
【包装】 铝塑包装。12片/板,1板/盒;12片/板,2板/盒;12片/板,3板/盒。
【有效期】36个月
【执行标准】国家药品监督管理局药品注册标准YBH17402021
【批准文号】国药准字H20223071
【药品上市许可持有人】
企业名称:珠海润都制药股份有限公司
注册地址:珠海市金湾区三灶镇机场北路6号
邮政编码:519041
联系方式:0756-7630088 0756-7630122
传真号码:0756-7630678 0756-7630123
不良反应反馈:电话:13702329078,邮箱:ywjj@rdpharma.cn
网 址:http://www.rdpharma.cn
【生产企业】
企业名称:珠海润都制药股份有限公司
生产地址:珠海市金湾区三灶镇机场北路6号
邮政编码:519041
联系方式:0756-7630088 0756-7630122
传真号码:0756-7630678 0756-7630123
不良反应反馈:电话:13702329078,邮箱:ywjj@rdpharma.cn
网 址:http://www.rdpharma.cn
031037-03